
Kalibrierung in der Pharmaindustrie
Was ist Datenintegrität? Warum ist Datenintegrität aktuell so wichtig? Was ist ALCOA plus?
Datenintegrität ist in keinerlei Hinsicht ein neuartiges Konzept, sondern bereits seit mehreren Jahrzehnten ein gängiger Begriff. In diesem Artikel möchten wir das Konzept Datenintegrität aus dem Blickwinkel des Kalibrierverfahrens beleuchten und uns dabei hauptsächlich auf die Pharmaindustrie und andere regulierte Industriesektoren konzentrieren. Lassen Sie uns zunächst einen Blick auf die Datenintegrität im Allgemeinen werfen, was dieser Begriff bedeutet, warum Datenintegrität wichtig ist und welche Folgen Verstöße haben können. Außerdem werden wir das „ALCOA plus“-Konzept kurz
erläutern.
Ich erinnere mich noch an die frühen 90er-Jahre, als wir Kunden aus der Pharmaindustrie hatten, die uns vor dem Kauf einer Kalibriersoftware auditieren ließen. Damals schon war Datenintegrität ein ganz normaler Punkt auf der Tagesordnung im Rahmen solcher Zuliefereraudits. Es handelt sich also in
keinerlei Hinsicht um ein neues Thema.
Reine Vertrauenssache
Wenn wir Produkte für den Alltagsgebrauch kaufen, ist es häufig so, dass man schnell erkennen kann, ob das Produkt ordnungsgemäß funktioniert oder fehlerhaft ist. Wenn Sie beispielsweise ein neues Fernsehgerät kaufen und es einschalten, sehen Sie schnell, ob es funktioniert oder nicht. Bei anderen Produkten lässt sich jedoch nicht so einfach erkennen, ob es in Ordnung ist oder nicht. Dies ist besonders bei Arzneimitteln der Fall. Woran können Sie bei einem Arzneimittel, das Sie sich besorgt haben, erkennen, ob das Produkt spezifikationsgemäß funktionieren wird? In den meisten Fällen wird das nicht möglich sein, es ist einfach Vertrauenssache – Sie müssen darauf vertrauen können, dass die Medizin, die Sie einnehmen, ordnungsgemäß wirken wird.
Was ist Datenintegrität?
Datenintegrität ist ein ausschlaggebender Bestandteil der Qualitätssicherung in der Pharmaindustrie, da hierdurch gewährleistet wird, dass die Produkte die erforderliche Qualität aufweisen.
Bei jedem Prozess werden große Datenmengen generiert. Datenintegrität ist die Aufrechterhaltung und Sicherstellung der Genauigkeit und Konsistenz der Daten über deren gesamten Lebenszyklus hinweg. Datenintegrität stellt einen kritischen Aspekt bei der Konzipierung, Implementierung und
Nutzung von Systemen jeglicher Art dar, die Daten speichern, verarbeiten oder abrufen. Der Begriff Datenintegrität wird ziemlich weitläufig genutzt und hat je nach Kontext unterschiedliche Bedeutungen. Der Begriff an sich ist bereits ziemlich alt und stammt ursprünglich aus der elektronischen Datenverarbeitung. Die Integrität der Daten, die durch Arzneimittelhersteller erfasst und gespeichert werden, ist ausschlaggebend für die Gewährleistung der hohen Qualität und Sicherheit der hergestellten Produkte. Zur Sicherstellung der Datenintegrität müssen die Daten vor unbeabsichtigter oder vorsätzlicher Modifikation, Fälschung oder Löschung geschützt werden.
In der Prozessindustrie kann bei vielen Verfahren das Endprodukt nicht einfach getestet werden, um herauszufinden, ob es ordnungsgemäß wirkt. Anstatt dessen muss sichergestellt werden, dass die bei den Prozessen vorherrschenden Bedingungen korrekt sind, damit die Produkte korrekt hergestellt werden. Diese kritischen Bedingungen müssen natürlich aufgezeichnet und gespeichert werden, damit diese Ordnungsmäßigkeit nachvollzogen werden kann. Dies ist sicherlich bei vielen Verfahren in einem Pharmaziewerk der Fall.
Warum ist Datenintegrität aktuell so wichtig?
Datenintegrität ist jedoch seit Kurzem zu einem noch wichtigeren Thema geworden als je zuvor.
Datenintegritätsbezogene Verstöße haben zu diversen regulatorischen Maßnahmen geführt wie Abmahnungen und Einfuhrwarnungen. Eine große Vielzahl aktueller Abmahnungen, die von der US-amerikanischen Lebensmittelüberwachungs- und Arzneimittelzulassungsbehörde FDA ausgegeben wurden, stehen in irgendeinem Zusammenhang mit Datenintegrität. Da Datenintegrität bei internationalen Regulierungsbehörden eine wichtigere Rolle spielt, wurden die Auditoren der FDA, WHOA und MHRA speziell geschult, um Datenintegritätsprobleme besser erkennen zu können.
Die MHRA (Medizinische Zulassungs- und Aufsichtsbehörde für Arzneimittel in Großbritannien) hat vor Kurzem einen neuen Leitfaden namens “GMP Data Integrity Definitions and Guidance for Industry” (März 2015) herausgegeben. Bis spätestens Ende 2017 müssen alle Pharmaunternehmen die zugehörigen Vorgaben in ihren Werken umgesetzt haben. Die FDA hat ihrerseits den Leitfaden “Data Integrity and Compliance With CGMP - Guidance for Industry” (April 2016) herausgegeben.
Momentan handelt es sich noch um einen Entwurf, der jedoch bereits in verschiedenen Diskussionsrunden vorgelegt wurde. Beide werden selbstverständlich Auswirkungen auf die Pharmaindustrie haben. Natürlich gab es auch schon davor Leitfäden für die gute Herstellungspraxis (CGMP), wie Teile des 21 CFR (210, 211 und 212), die sich mit datenintegritätsbezogenen Problemen befassten, die erwähnten neuen Aktualisierungen schärfen den Fokus jedoch weiter.
Ein weiterer Grund dafür, dass Datenintegrität weiter in den Mittelpunkt gerückt ist, ist der zunehmende Gebrauch von mobilen Geräten im Rahmen von Kalibriervorgängen. Hierzu zählen auch Apps für Tablets und Mobiltelefone. Des Weiteren kommt der zunehmende Gebrauch von dokumentierenden Kalibratoren hinzu, die die Kalibrierergebnisse im Zuge der Kalibrierung automatisch im integrierten Speicher ablegen und diese Daten an Kalibriersoftware übertragen. Da der Einsatz von automatisierten dokumentierenden Kalibratoren die Wirtschaftlichkeit von Kalibriersystemen optimiert, kommen diese immer häufiger zum Einsatz. Genauere Informationen dazu, was dokumentierende Kalibratoren sind und welche Vorteile sie für Kalibriervorgänge bringen, finden Sie in unserem Blog-Post: Was ist ein dokumentierender Kalibrator und wie kann ich davon profitieren? (in englischer Sprache)
All dies führt dazu, dass Datenintegrität zu einem immer wichtigeren Thema wird.
Auswirkungen von Verstößen gegen die Datenintegrität
Verstöße gegen die Datenintegrität können zweierlei Auswirkungen haben: auf den Kunden und auf das Pharmaunternehmen.
Der Kunde kann insofern betroffen sein, als dass das Arzneimittel nicht die erforderliche Wirkung erzielt, die Patientensicherheit beeinträchtigt ist und im schlimmsten Fall sogar Todesfälle auftreten können.
Für das Pharmaunternehmen kann dies eine Abmahnung von der FDA, einen Herstellungslizenzentzug, einen Imageschaden, den Verlust des Kundenvertrauens, eine Schmälerung des Marktanteils und einen Kursverfall der Unternehmensaktien bedeuten.
Unbeabsichtigt / Vorsätzlich
Verstöße gegen die Datenintegrität können unbeabsichtigt oder vorsätzlich sein. Häufig sind computergestützte Systeme zur Handhabung der Daten involviert und die Benutzer bekommen von Problemen in solchen Systemen oftmals nichts mit. Selbstverständlich sind die meisten Datenintegritätsprobleme unbeabsichtigter und nicht vorsätzlicher Natur. Nichtsdestotrotz, wenn wir einen Blick in die Abmahnungen der FDA werfen, werden wir sehen, dass es in den allerschlimmsten Fällen sogar zu vorsätzlicher Datensatzfälschung gekommen ist.
Wichtigste Schritte zur Optimierung der Datenintegrität
In Bezug auf die wichtigsten Schritte zur Optimierung der Datenintegrität scheinen sich viele Pharmaunternehmen einig zu sein:
• Bessere Ausbildung und Kommunikation
• Risikoerkennung und Risikominderung
• Schwerpunkt Technologie und IT-Systeme
• Kontrolle der Datenintegrität
Auch Validierung ist ein Muss für jedes computergestützte System in der Pharmaindustrie. Und es ist gut, sich die ANSI-Definition für „System“ in Erinnerung zu rufen: „Zur Ausführung spezifischer Funktionen in einer Organisationsstruktur zusammengefasste Menschen, Maschinen und Verfahren. Das heißt, nicht nur das Computersystem muss validiert werden.
ALCOA und ALCOA plus
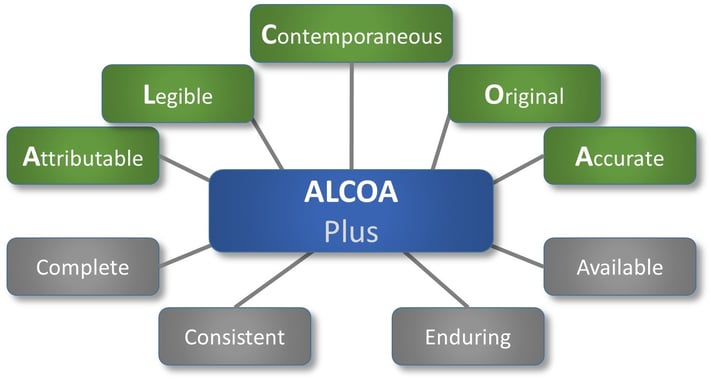
Das Akronym ALCOA ist schon seit den 1990er-Jahren ein gängiger Begriff. ALCOA wird von den regulierten Industrien als Rahmenwerk für die Gewährleistung der Datenintegrität benutzt und ist ausschlaggebend für die gute Dokumentationspraxis (GDP). ALCOA nimmt Bezug auf Daten, egal ob in Papierform oder im elektronischen Format, die in den FDA-Leitfäden folgendermaßen definiert werden:
• zuschreibbar (Attributable)
• lesbar (Legible)
• gleichzeitig/zeitnah (Contemporaneous)
• original (Original)
• korrekt (Accurate)
Mit ALCOA Plus erweitert sich die Liste der Eigenschaften:
• vollständig (Complete)
• konsistent (Consistent)
• dauerhaft (Enduring)
• verfügbar (Available)
In dem von uns zum Thema erstellten White Paper finden Sie detaillierte Informationen zu ALCOA Plus.
Was könnte zu Datenintegritätsproblemen führen?
Es gibt bestimmte praxisbezogene und allgemeine Aspekte, die in jeglichem System zu Datenintegritätsproblemen führen können, wie zum Beispiel: mangelhafte Schulung, Nutzerprivilegien, unsichere oder geteilte Passwörter, Steuerung eines computergestützten Systems, unvollständige Dateneingabe sowie fehlende Prüfdatenvermerke für Abänderungen und Modifikationen.
Zu vermeidende Kundenfalle Nr. 1: Gefälschte Arzneimittel
Auch wenn dies für die Industrie kein Datenintegritätsproblem als solches darstellt, handelt es sich dennoch um ein ernstzunehmendes Problem für Verbraucher. Die Menschen kaufen immer mehr Produkte über das Internet, darunter auch Arzneimittel. Leider jedoch erhält man nicht immer das, was man bestellt hat. Eine große Vielzahl an Arzneimitteln, die online bestellt werden, sind Fälschungen. Manchmal ist die Verpackung bereits ganz offensichtlich nicht korrekt, das heißt man sieht auf den ersten Blick, dass es sich um eine Fälschung handelt. Das ist jedoch leider nicht immer der Fall, weshalb es immer wieder passiert, dass Menschen gefälschte Arzneimittel benutzen. Gefälschte Arzneimittel werden nicht die gewünschte Wirkung erzielen, das liegt auf der Hand, jedoch stellen diese Fälschungen auch ein großes Risiko für unsere Sicherheit dar und viel schlimmer noch, sie können sogar tödlich sein.
Neue Bestimmung für Arzneimittelverpackungen zur Vorbeugung von Fälschungen
Zur besseren Kontrolle von Arzneimittelfälschungen hat die EMA (Europäische Arzneimittelagentur) jüngst eine neue Bestimmung herausgebracht, die alle Hersteller von verschreibungspf lichtigen Arzneimitteln aus allen EU-Ländern (mit Ausnahme von drei Ländern) dazu verpflichtet, ab Februar 2019 neue Sicherheitsmerkmale in ihre Arzneimittelverpackungen zu integrieren. Laut dieser Bestimmung, die Teil einer breiter angelegten Kampagne zur Bekämpfung von Arzneimittelfälschungen in der EU ist, werden Pharmahersteller dazu verpflichtet werden, die Verpackungen der meisten zentral zugelassenen Arzneimittel mit einer eindeutigen Bezeichnung und einem Fälschungssicherungselement zu versehen. Diese Maßnahme erfolgt natürlich erneut zu Lasten der Pharmahersteller, sowohl in Bezug auf den Aufwand als auch hinsichtlich der Kosten für die entsprechenden Systeme zur Umsetzung dieser Bestimmung, dennoch werden andererseits die Kunden davon klar profitieren. Auch wenn diese spezifische Bestimmung nur für die Europäische Union gilt, werden sich die Auswirkungen global bemerkbar machen.
Fazit
Obwohl es das Konzept der Datenintegrität schon seit langer Zeit gibt, hat es in jüngster Zeit infolge der zunehmenden Nutzung von mobilen Geräten und der erhöhten Aufmerksamkeit der Regulierungsbehörden an Aktualität gewonnen. Auch wenn Datenintegrität ‒ Gewährleistung der Unversehrtheit der Daten über ihren gesamten Lebenszyklus ‒ letztendlich eigentlich dem gesunden Menschenverstand zuzuordnen ist, gestaltet sich die Angelegenheit in der Praxis mit unterschiedlichen Systemen und Tools doch komplizierter. Da die Auswirkungen von Verstößen gegen die Datenintegrität von unermesslichem Ausmaß sein können, muss diesem Thema die angemessene Priorität beigemessen werden.
In einem weiteren Blog Post, der später folgt, werde ich mich mehr mit den praktischen Dingen wie „Was kann Probleme bei der Datenintegrität in einer normalen Prozesskalibrierungsumgebung verursachen beschäftigen; unabhängig davon, ob es ein papierbasiertes oder ein papierloses System ist und ob es ausgelagert oder integriert ist“.
Bitte das Bild anklicken um einen kostenlosen Artikel herunterzuladen:
Zugehörige Beamex Produkte
Die Verwendung des dokumentierenden Beamex-Kalibrators MC6 mit der Option „Security Plus“ garantiert die Integrität der Kalibrierdaten im Verlauf des Kalibrierprozesses, wenn dieser in Verbindung mit der Beamex CMX Kalibrier-Management-Software eingesetzt wird.
Verwandte nützliche Referenzen (in englischer Sprache):
21 CFR Part 11, Electronic Records; Electronic Signatures:
http://www.fda.gov/RegulatoryInformation/Guidances/ucm125067.htm
MHRA GMP Data Integrity Definitions and Guidance for Industry, March 2015:
https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/412735/Data_integrity_definitions_and_guidance_v2.pdf
Data Integrity and Compliance with CGMP Guidance for Industry DRAFT GUIDANCE, April 2016:
http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm495891.pdf
FDA warning letters are public and can be found here:
http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/default.htm
European Medicines Agency (EMA), recent regulation for product packaging:
http://www.raps.org/Regulatory-Focus/News/2016/02/09/24281/EU-Regulation-Requires-New-Safety-Features-on-Drug-Packaging-by-2019/
Originaler Blog Post: Data Integrity in Calibration Processes
Veröffentlich: 15.3.2017
Verfasst durch Heikki Laurila.



















.jpg)





.png)
Diskussion