
En tant que consommateurs de produits pharmaceutiques, nous voulons tous être sûrs de pouvoir faire confiance aux produits fabriqués par l’industrie pharmaceutique. Heureusement, l’industrie pharmaceutique est extrêmement réglementée et ses opérations sont contrôlées en permanence. La Food and Drug Administration (FDA) est la principale autorité de régulation qui audite régulièrement les entreprises pharmaceutiques à l’échelle mondiale afin de garantir leur conformité.
Chaque année, la FDA adresse des centaines d’avertissements aux entreprises pharmaceutiques qui ne se conforment pas aux réglementations. Même, elles ne sont pas parfaites ! La plupart des avertissements ne sont pas liés à l’étalonnage, mais certains le sont. J’ai analysé les avertissements relatifs à l’étalonnage et dans cet article, je vais lister les avertissements les plus couramment adressés relatifs à l’étalonnage. Si ça vous intéresse, je vous invite à poursuivre votre lecture.
Sommaire
Je vous recommande de parcourir l'ensemble de l'article, mais vous pouvez directement cliquer ci-dessous pour accéder au sujet de votre choix :
- La FDA dans les grandes lignes
- Déviations et injonctions
- Les déviations les plus courantes
- Les déviations les plus courantes relatives à l’étalonnage et la métrologie
- Les trois principales raisons d’avertissements liés à l’étalonnage et comment les éviter.
- Comment Beamex peut vous aider
La FDA dans les grandes lignes
La FDA (https://www.fda.gov/) est une agence du gouvernement américain dédiée à la protection de la santé publique qui garantit la sécurité, l’efficacité et la sécurité des médicaments, des produits biologiques et des dispositifs médicaux.
La FDA audite les entreprises pharmaceutiques et vérifie que leur fonctionnement est conforme aux réglementations applicables. Bien que la FDA soit une autorité américaine, toute entreprise pharmaceutique voulant vendre sur le sol américain doit se conformer aux réglementations de la FDA et sera soumise à leur processus d’audit. Ainsi, dans les faits, les exigences de la FDA sont mondiales.
Si la FDA trouve des preuves de non-conformité durant ses audits, elle produira un formulaire 483 qui pourra entraîner l’envoi d’une injonction La FDA possède même le pouvoir de faire fermer une usine en cas de grave non-conformité.
Ainsi, c’est évident que les entreprises pharmaceutiques sont sur leurs gardes dès qu’un auditeur de la FDA arrive.
Outre la FDA, il existe d’autres autorités de régulation auditant les entreprises pharmaceutiques, comme l’Agence européenne du médicament (EMA) et la Medicines & Healthcare Products Regulatory Agency (MHRA) britannique, ainsi que d’autres agences nationales dans d’autres pays. Les entreprises pharmaceutiques sont donc auditées régulièrement par d’autres autorités de régulation en plus de la FDA.
Heureusement, les Multilateral Recognition Agreements (MRA) entre les différentes autorités de régulation continuent à se développer afin que les entreprises pharmaceutiques ne soient pas sujettes à de multiples audits de divers organismes.
Déviations et injonctions
Comme mentionné plus haut, quand un auditeur de la FDA enquête dans une entreprise pharmaceutique, les observations de non-conformité sont notées dans le formulaire 483. En fonction du niveau de risques et/ou du nombre d’observations, cela peut mener à l’envoi d’une injonction. L’entreprise pharmaceutique doit alors émettre une réponse à cette lettre et réaliser des actions correctives suffisantes pour corriger les faits observés.
Ces avertissements sont de notoriété publique et sont consultables sur le site de la FDA en suivant ce lien : https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters
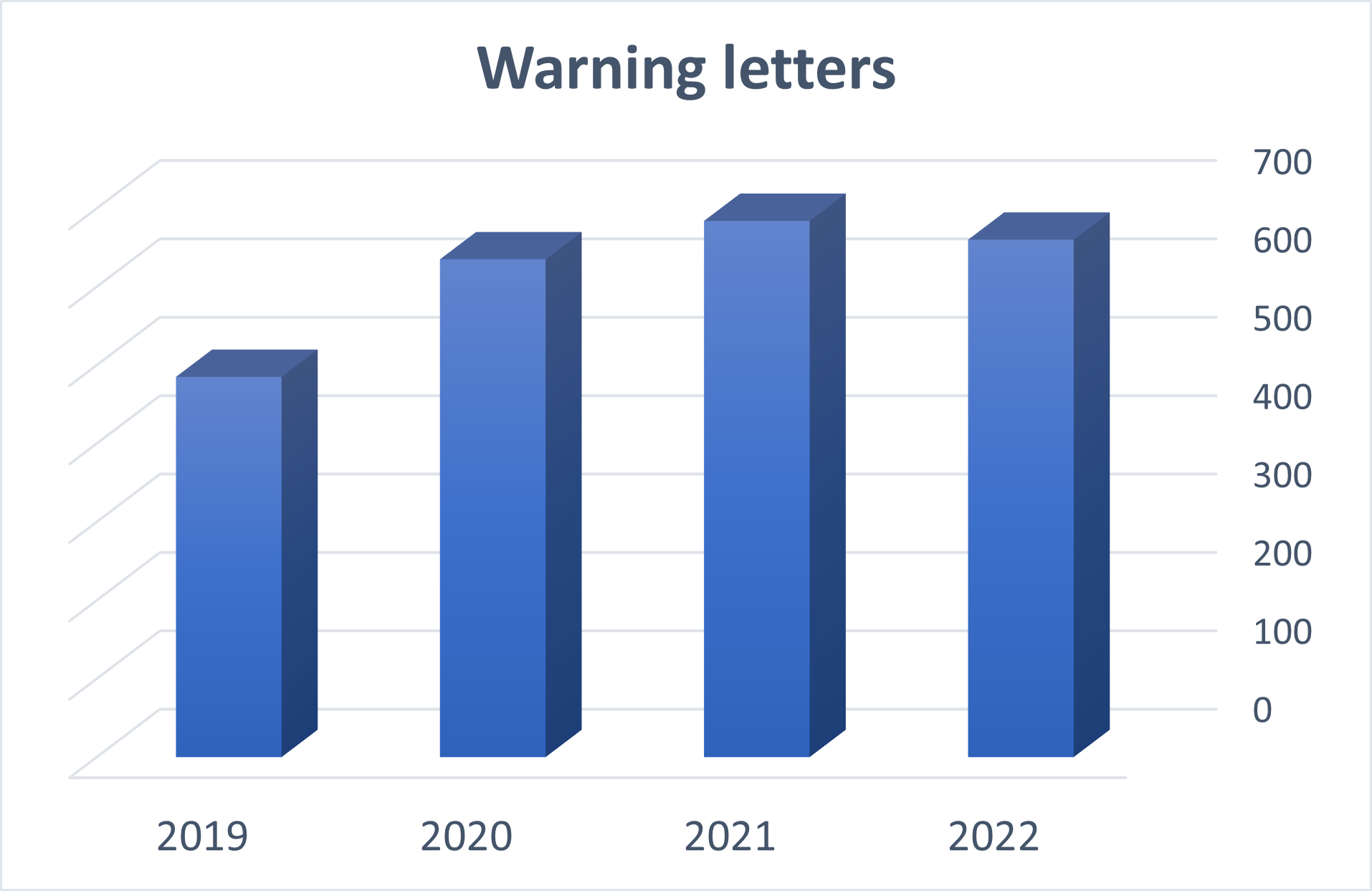
Il y a actuellement près de 3 000 injonctions listées sur le site de la FDA datant de 2019 à aujourd’hui.
Sur les trois dernières années, environ 600 injonctions ont été adressées chaque année, réparties comme suit :
Les déviations les plus courantes
Le nombre de lettres étant tellement important, les analyser toutes s’avère compliqué, mais des informations disponibles listent les raisons les plus courantes des déviations :
- L’absence de procédures écrites, ou le non-respect des procédures écrites
- Des problèmes d’enregistrement des données et d’intégrité des données
- La validation des procédés de fabrication : un manque de contrôle de fabrication
- De la publicité mensongère ou trompeuse
- Des problèmes relatifs aux contrôles environnementaux
De nombreux avertissements sont englobés par le terme « non-conformité aux Bonnes Pratiques de Fabrication ».
Les déviations les plus courantes relatives à l’étalonnage et la métrologie
Cependant, cet article n’est pas dédié à toutes les injonctions et déviations, nous nous concentrons ici uniquement sur celles liées à l’étalonnage et la métrologie. Il va sans dire que mon sujet de prédilection reste l’étalonnage 😊
J’ai donc étudié toutes les déviations de ces trois dernières années : 2020, 2021 et 2022. Près de 2 000 injonctions ont été émises sur ces 3 années !
Si on regarde le nombre d'injonctions relatives à l’étalonnage, on peut voir qu’elles ne constituent qu’une petite part des avertissements. Seulement 2 % des injonctions incluent des commentaires sur l’étalonnage.
Bien que la plupart de ces entreprises soient situées aux États-Unis, certaines sont en Amérique du Sud, en Europe ou en Asie.
Bien évidemment, certains des avertissements génériques peuvent inclure l’étalonnage sans le mentionner séparément. C’est le cas des problèmes de maintenance, de l’absence de procédures écrites, de problèmes d’enregistrement des données et de contrôles de production, pour en citer quelques-uns.
J’ai analysé la totalité des injonctions mentionnant l’étalonnage. Regardons ensemble les sujets les plus courants.
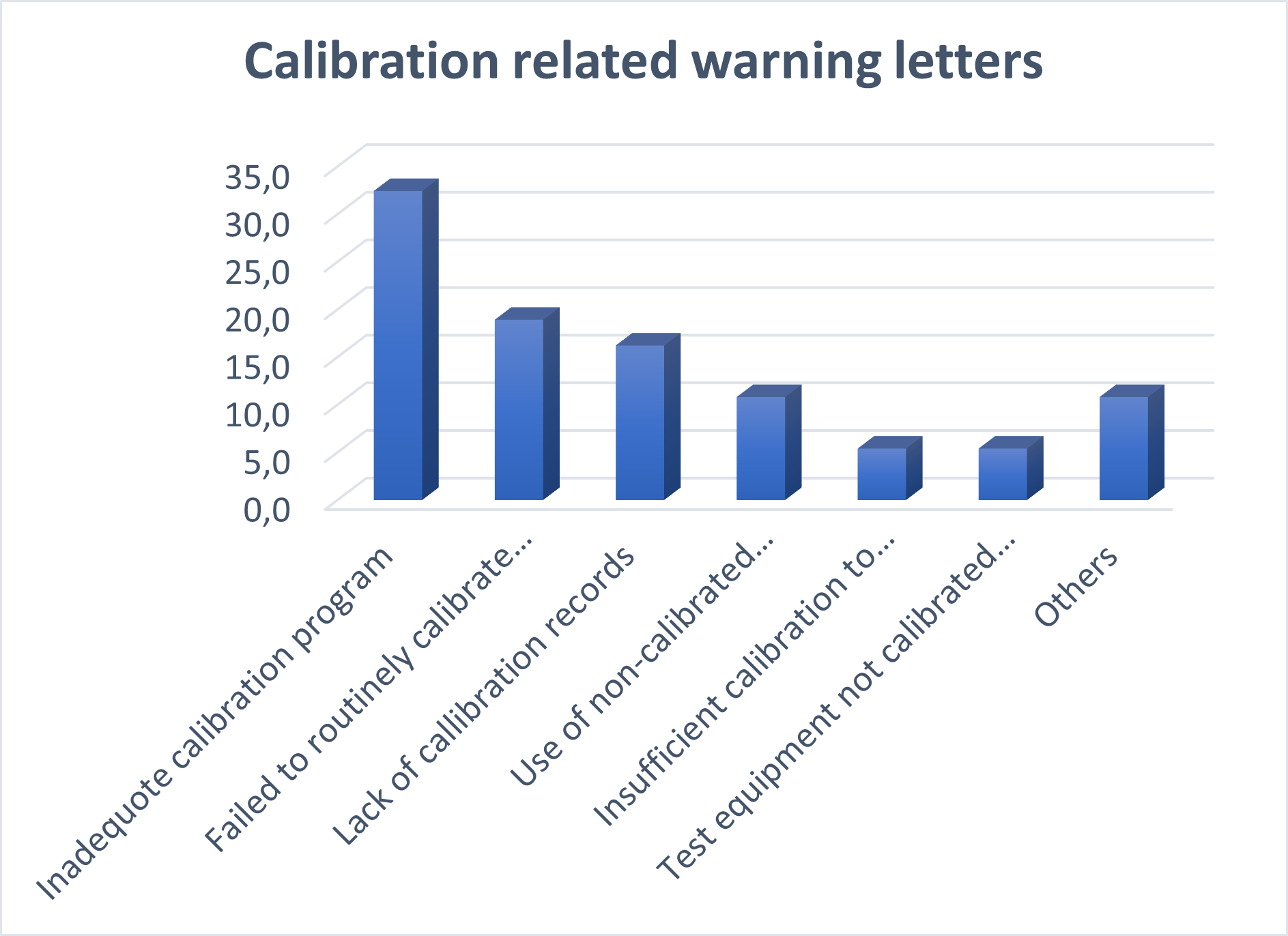
J’ai groupé les avertissements relatifs à l’étalonnage dans les catégories suivantes et indiqué leur pourcentage dans la liste suivante :
- Programme d’étalonnage inadapté : 33 %
- Manque d’étalonnage régulier des instruments : 19 %
- Manque d’enregistrement des étalonnages : 16 %
- Utilisation d’instruments d’étalonnage non étalonnés : 11 %
- Étalonnage insuffisant pour prouver l’exactitude requise : 5 %
- Équipement de test non étalonné pour la plage requise : 5 %
- Tout le reste : 11 %
Le graphique ci-dessous illustre les avertissements les plus courants relatifs à l’étalonnage
Les trois raisons principales d’avertissements liés à l’étalonnage et comment les éviter
Intéressons-nous aux trois principales raisons d’avertissements liés à l’étalonnage et voyons comment les éviter.
1. Programme d’étalonnage inadapté
Comme on peut le voir, la raison principale est un « programme d’étalonnage inadapté » qui englobe un tiers (33 %) des cas. Dans ces cas, l’entreprise ne dispose pas d’un programme d’étalonnage adapté qui documente comment et quand chaque instrument doit être étalonné.
Créer et documenter son programme d’étalonnage est une tâche fondamentale pour le personnel responsable de l’étalonnage. C’est bien souvent un peu plus exigeant de s’assurer que le programme est « adapté » pour les auditeurs FDA et qu’il est conforme à toutes les réglementations de la FDA.
2. Manque d’étalonnage régulier des instruments
La deuxième raison la plus courante est le « manque d’étalonnage régulier des instruments » qui représente 19 % des cas. Dans ces cas-là, l’entreprise n’a tout simplement pas étalonné tous les instruments qu’elle aurait dû.
La meilleure façon de régler ce problème consiste à utiliser un système automatisé qui vous prévient quand les instruments doivent être étalonnés et qui garantit que tous les étalonnages sont réalisés.
3. Manque d’enregistrement des étalonnages
La troisième raison la plus courante est le « manque d’enregistrement des étalonnages » qui représente 16 % des cas. Cela signifie que les entreprises n’ont pas de preuve que les étalonnages ont bien été réalisés. C’est assez similaire au problème précédent, mais dans ces cas-là, l’entreprise a été capable de convaincre l’auditeur que l’étalonnage avait bien eu lieu, mais n’a pas de document pour le prouver, comme des certificats d’étalonnage.
La meilleure manière de résoudre ce problème est de vous assurer que votre système de gestion des étalonnages stocke numériquement tous vos étalonnages, de manière à pouvoir facilement récupérer les données dès qu’un auditeur veut les voir.
Comment Beamex peut vous aider
Cela fait de nombreuses années que nous travaillons et que nous nouons des partenariats avec des entreprises pharmaceutiques. De nombreux leaders de l’industrie pharmaceutique et des sciences de la vie s’appuient sur l’écosystème d’étalonnage Beamex, conçu pour aider les clients à atteindre tous leurs objectifs d’étalonnage conformément aux réglementations en vigueur, comme celles de la FDA.
De nombreuses fonctionnalités développées pour notre écosystème de gestion de la métrologie l’ont été pour répondre aux exigences des entreprises pharmaceutiques.
Pour l’industrie pharmaceutique, nous proposons par exemple :
- Un logiciel de métrologie industrielle doté de nombreuses fonctionnalités développées spécifiquement pour les entreprises pharmaceutiques ;
- De l’équipement d’étalonnage pour les étalonnages sur le terrain et en atelier ;
- Divers services d’expertise dédiés à l’industrie pharmaceutique.
Si vous êtes un acteur de l’industrie pharmaceutique, contactez-nous pour en savoir plus sur la façon avec laquelle nous pouvons vous aider à vous conformer à toutes les exigences d’étalonnage de la FDA :
Articles similaires
Si vous avez trouvé cet article intéressant, vous aimerez peut-être aussi ceux-ci :
- Améliorer l'efficacité et la conformité dans l'industrie pharmaceutique
- Suivre les tendances de l'industrie pharmaceutique
- La saisie manuelle des données : source d'erreurs
- L'intégrité des données d'étalonnage
- Voir nos solutions pour l'industrie pharmaceutique
Téléchargez votre exemplaire de la digitalisation de la métrologie :




.png)



















Discussion